การเปลี่ยนสถานะของน้ำ
แม้ว่าองค์ประกอบส่วนใหญ่ของบรรยากาศจะเป็นไนโตรเจนและออกซิเจน แต่แก๊สทั้งสองชนิดไม่ได้มีอิทธิพลต่อการเปลี่ยนแปลงสภาพอากาศ เนื่องจากมีจุดหลอมเหลวและจุดเยือกแข็งต่ำมาก อุณหภูมิของบรรยากาศและพื้นผิวโลกสูงเกินกว่าที่จะทำให้แก๊สทั้งสองชนิดเปลี่ยนสถานะได้ ยกตัวอย่าง หากจะทำให้แก๊สไนโตรเจนในอากาศเปลี่ยนสถานะเป็นของเหลว อุณหภูมิอากาศจะต้องลดต่ำลงถึง -196°C ซึ่งเป็นไปไม่ได้เนื่องจากโลกอยู่ใกล้ดวงอาทิตย์มากเกินไป ในทางตรงข้ามแม้บรรยากาศจะมีไอน้ำอยู่เพียงเล็กน้อย ประมาณ 0.1 - 4% แต่ก็มีอิทธิพลทำให้เกิดการเปลี่ยนแปลงสภาพอากาศได้อย่างรุนแรง เป็นเพราะว่าน้ำในอากาศสามารถเปลี่ยนสถานะกลับไปกลับมาได้ทั้งสามสถานะ เนื่องจากอุณหภูมิ ณ จุดหลอมเหลวและจุดเยือกแข็งของน้ำไม่แตกต่างกันมาก
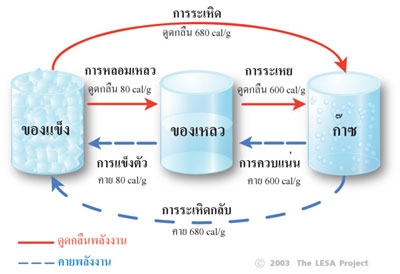
ไอน้ำ (Vapor) คือน้ำที่อยู่ในสถานะแก๊ส ไอน้ำเป็นแก๊สที่ไม่มีสี ไม่มีกลิ่น โปร่งใสมองไม่เห็น น้ำในอากาศสามารถเปลี่ยนจากสถานะหนึ่งไปสู่อีกสถานะหนึ่งกลับไปกลับมาได้ โดยไม่ต้องพึ่งพาการถ่ายเทความร้อนและมวลสารจากสิ่งแวดล้อม กลไกการเปลี่ยนแปลงในลักษณะนี้เรียกว่า "กระบวนแอเดียแบติก" (Adiabatic process) การเปลี่ยนสถานะของน้ำทำให้การดูดกลืนหรือการคายความร้อนซึ่งเรียกว่า “ความร้อนแฝง” (Latent heat) ดังที่แสดงในภาพที่ 1 ความร้อนแฝงมีหน่วยวัดเป็นแคลอรี 1 แคลอรี เท่ากับปริมาณความร้อนซึ่งทำให้น้ำ 1 กรัม มีอุณหภูมิสูงขึ้น 1°C (ดังนั้นหากเราเพิ่มความร้อน 10 แคลอรี ให้กับน้ำ 1 กรัม น้ำจะมีอุณหภูมิสูงขึ้น 10°C)

ภาพที่ 1 พลังงานที่ใช้ในการเปลี่ยนสถานะของน้ำ
การหลอมเหลว (Melting) คือ การที่น้ำเปลี่ยนสถาะนะจากของแข็งเป็นของเหลว เมื่อเพิ่มพลังงานความร้อนให้แก้วซึ่งบรรจุน้ำแข็ง น้ำแข็งจะดูดกลืนความร้อนนี้ไว้ โดยยังคงรักษาอุณหภูมิ 0°C คงที่ไม่เปลี่ยนแปลง จนกว่าน้ำแข็งจะละลายหมดก้อน ความร้อนที่ถูกดูดกลืนเข้าไปจะทำลายพันธะไฮโดรเจนในโครงสร้างผลึกน้ำแข็ง ทำให้น้ำแข็งเปลี่ยนสถานะเป็นของเหลว โดยมีอัตราการดูดกลืนความร้อนแฝง 80 แคลอรี/กรัม
การแข็งตัว (Fleezing) คือ การที่น้ำเปลี่ยนสถานะจากของเหลวเป็นของแข็ง ซึ่งน้ำจำเป็นต้องถ่ายเทพลังงานภายในออกมาในรูปของการคายความร้อนแฝง 80 แคลอรี/กรัม เพื่อลดแรงสั่นสะเทือนของโมเลกุล เพื่อให้พันธะไฮโดรเจนสามารถยึดเหนี่ยวโมเลกุลให้จับตัวกันเป็นโครงสร้างผลึก
การระเหย (Evaporation) คือ การที่น้ำเปลี่ยนจากสถานะของเหลวเป็นแก๊ส เมื่อเพิ่มพลังงานความร้อนให้แก้วซึ่งบรรจุน้ำ น้ำจะดูดกลืนความร้อนนี้ไว้ โดยยังคงรักษาอุณหภูมิ 100°C คงที่ไม่เปลี่ยนแปลง จนกว่าน้ำจะระเหยกลายเป็นไอน้ำหมดแก้ว โดยใช้อัตราการดูดกลืนความร้อนแฝง 600 แคลอรี/กรัม
การควบแน่น (Condensation) คือ การที่น้ำเปลี่ยนจากสถานะแก๊สเป็นของเหลว ซึ่งน้ำจำเป็นต้องถ่ายเทพลังงานภายในออกมาในรูปของการคายความร้อนแฝง 600 แคลอรี/กรัม เพื่อลดแรงดันของระหว่างโมเลกุล
การระเหิด (Sublimation) คือ การที่น้ำเปลี่ยนจากสถานะจากของแข็งเป็นแก๊สโดยตรง ซึ่งต้องการดูดกลืนความร้อนแฝง 680 แคลอรี/กรัม
การระเหิดกลับ (Deposition) คือ การที่น้ำเปลี่ยนจากสถานะแก๊สเป็นของแข็ง ซึ่งน้ำจำเป็นต้องถ่ายเทพลังงานภายในออกมาในรูปของการคายความร้อนแฝง 680 แคลอรี/กรัม

ภาพที่ 2 กราฟแสดงความร้อนแฝงที่ใช้เปลี่ยนสถานะของน้ำ
ก = สถานะของแข็ง, ข = หลอมละลาย, ค = สถานะของเหลว, ง = การระเหย
อย่างไรก็ตามในการระเหยและควบแน่นของน้ำในธรรมชาตินั้น ไม่จำเป็นต้องรอให้อุณหภูมิสูง 100°C การระเหยและควบแน่นของน้ำ ขึ้นอยู่กับปัจจัยหลายประการ เช่น ความสูงจากระดับน้ำทะเลปานกลาง ความกดอากาศ พลังงานแสงอาทิตย์ และกระแสลม เป็นต้น